

 |
 |
|
Навигация
|
Главная » Мануалы металлургия ВЫСОКОТЕМПЕРАТУРНОЕ ОКИСЛЕНИЕ Дж.Л.Смиалек и Дж.Х.Мейлер (James L. Smialek and Gerald Н. Meiler, NASA Lewie Re-searchCenter, Cleveland, Ohio, and University of Pittsburgh, Pittsburgh, Pennsylvania) Стойкость no отношению к окислительным средам при высоких температурах - этому требованию суперсплавы должны удовлетворять независимо от того, имеется на них защитное покрытие или нет. Следовательно, для успешного проектирования и использования суперсплавов очень важно понять ирироду процессов их окисления, а также зависимость этих процессов от свойств сплавов и условий их эксплуатации. в этой главе мы дадим краткий обзор сведений об основах окислительных процессов металлов и сплавов, а затем обсудим поведение простых сплавов, образующих соединения СГ2О3 и AI2O3. Далее рассмотрим влияние обычных легирующих элементов на характер окисления этих базовых систем сплавов и заложим тем самым основу для расширенного рассмотрения и трактовки процессов окисления, которым подвергаются сложные суперсплавы. 11.1. Основные принципы окисления сплавов В этом разделе мы кратко рассмотрим основные представления об окислении металлов и сплавов Чистые металлы Согласно ряду наблюдений скорость роста оксидного слоя, определяемая характеристиками диффузии, обычно может быть описана уравнением dx/dt = k/x, (11.1) где X- толщина оксидного слоя, а А:- параболическая константа скорости , имеющая размерность см/с. После интегрирования получим: х]-х] = 2k{t - 0> (11-2) о где (о - время, по истечению которого диффузия начинает оказывать определяющее влияние на процесс окисления. Степень развития реакции можно выразить и в терминах изменения массы на единицу поверхности, Lm/А, т.е.
= 2k (t - О, (11.3) где к = (8/УУк' г^/см\ (11.4) а V- эквивалентный объем оксида (размерности и преобразования рассмотрены в гл.З по данным Briks and Meier [1]). Значение к' проанализировали теоретически [2], исходя из следующих допущений. 1. Оксидный слой представляет собой плотную окалину, его связь с подложкой соверщенна. 2. Скорость процесса определяется миграцией ионов или электронов сквозь окалину. 3. Термодинамическое равновесие устанавливается на обеих поверхностях раздела, между металлом и оксидом и между оксидом и газовой средой. 4. Отклонение оксида от стехиометрии очень невелики. 5. В поперечном сечении окалины устанавливается локальное термодинамическое равновесие. 6. Толщина окалины велика по сравнению с расстояниями, в которых действует пространственный заряд. 7. Растворимостью кислорода в металле можно пренебречь. Результаты этого анализа [2] можно представить следующим выражением: Do + (11.5) где и Do - коэффициенты диффузии соответственно металла и кислорода в оксидном слое, Zy- объем металла, а fig и fig- химический потенциал кислорода на поверхности раздела соответственно металл-оксид и оксид-газовая среда. Было показано [З], что для реакции многих металлов с кислородом, серой и галогенами экспериментальные значения констант процесса неплохо коррелируют со знaчeнияв^, вычисленными по теории Вагнера [2]. И все-таки большинство данных отклоняется от модели Вагнера из-за того что упомянутые выше вагнеровские допущения неприемлемы для тех или иных реальных систем. Это особенно проявляется, когда нарушено допушение 2, так что рост окалины не отвечает простому параболическому закону уравнений (11.2) или (11.3). Тем не менее, константы параболического уравнения скорости удобно использовать для сравнения относительных скоростей окисления в тех многочисленных случаях, когда поведение системы хотя бы приблизительно следует параболическому закону (рис. 11.1). По сравнению с окислением чистых металлов окисление сплавов - более сложный процесс. Согласно Вагнеру [4], сплавы можно подразделить на две группы: 1 - благородная матрица, содержащая легирую-шие элементы, отличающиеся большей основностью ( менее благородные ), чем матрица, и 2 - основная матрица, содержащая основные легирующие элементы. Типичное строение окисляющихся систем этих двух видов представлено на рис. 11.2 и 11.3. Были тщательно проанализированы диф- Рис.11.1. Порядок величины констант для скорости роста некоторых оксидов 1150 Т. С 1050 -12 -
7,4 7,6 фузионные процессы [5], приводящие к возникновению такого и других видов строения окисляющихся систем. На рис. 11.2 элемент А представляет собой благородную матрицу (иными словами, он не будет вступать в реакцию с кислородом при окружающем давлении кислорода рО, а элемент В имеет основную природу и растворен в благородной матрице (иначе говоря, давление диссоциации оксида ВО меньше, чем значе-10 ние рО в окружающей среде). Если концентрация Б в растворе невелика, а кислород растворим в матрице А, возникает строение, показанное на рис. 11.2,а, здесь происходит внутреннее окисление с образованием выделений ВО. В самом простом случае, когда соединение ВО очень стабильно и выполнено . условие Db -Do. глубину внутреннего окисления X можно написать как X(f) = N° (11.6) ,(o) где Л^* - растворимость кислорода, а N - объемное содержание элемента В [обе величины в % (ат.)]. Уравнение (11.6) показывает, что величина X (О уменьшается с ростом Nf\ и когда в системе достаточно много элемента В, его поток из внутренних объемов к наружной поверхности приводит к образованию соединения ВО в виде сплошного поверхностного слоя (рис. 11.2,5). Для такого перехода от внутреннего окисления к наружному должно выполняться условие N%>Nl\ где . (КР.) С (Л - N о- DbV о xJ (11.7) и и Vox ~ молярные объемы соответственно сплава и оксида, а g - критическая объемная доля оксида, необходимая для перехода; во многих случаях g < 0,3. Рис. 11.3 иллюстрирует более распространенный случай, когда в контакте с газовой фазой устойчивы оба оксида, АО Рис.11.2. Схема разреза и концентрационного профиля для благородного металла А, легированного активным металлом В: а - сплав с низким содержанием В демонстрирует внутреннее окисление В; б - сплав с высоким содержанием В демонстрирует образование наружного слоя ВО А-В А-В leoi
Рис.11.3. Схема разреза сплава А-В, оба компонента которого образуют устойчивые оксиды, однако ВО более стоек, чем АО: а - сплав с низким содержанием В демонстрирует внутреннее окисление В под наружным слоем АО; б - сплав с высоким содержанием В демонстрирует образование наружного слоя ВО и ВО, но оксид во более устойчив (при рассмотрении суперсплавов символом А обычно обозначают Ni или Со, а символом В- Сг, Al, Ti и другие элементы). При низких концентрациях в будет образовываться поверхностный слой АО, а оксиды ВО, образующиеся путем внутреннего окисления, выделяются во внутренних объемах сплава (рис. 11.3,а). Если концентрация В повышается и превосходит критический уровень перехода к наружному окислению, формируется строение, представленное на рис. 11.3,5. Создание сплошного слоя ВО кладет конец продолжению формирования оксида АО, если последний менее устойчив, чем ВО, хотя до создания совершенного слоя ВО образуется некоторое количество соединения АО (стадия переходного окисления ). Строение, представленное на рис. 11.3,5, и является целью легирования, направленного на повышение противоокислительной стойкости. Иными словами, легирующий элемент В, оксид которого очень стабилен и медленно растет, вводят в количестве, достаточно большом для формирования поверхностного защитного слоя посредством избирательного окисления [6]. Скорость окисления сплава по схеме рис. 11.3,5 фактически будет соответствовать параболическому закону, в котором константа скорости определяется поведением оксида ВО. Однако избирательное окисление приводит к обеднению сплава по элементу В под окалиной (см. концентрационный профиль на рис. 11.3,5). В конечном счете такое обеднение будет проводить к обогащению окалины оксидами элемента А, а скорость окисления возрастет до уровня, присущего образованию оксида АО. Время, которое потребуется для перехода к более высокой скорости окисления будет зависеть от многих факторов; к ним относятся температура, размеры образца, коэффициенты диффузии в сплаве и в окалине, а так-12 же исходная концентрация элемента В^ в сплаве. Этот переход ускоряется любым процессом, который снижает защитную способность слоя ВО, например испарением летучих оксидов (как испарение CrOj из CfjOj), которое приводит к утонению защитного слоя или в результате механического эрозионного повреждения какими-либо частицами, либо за счет растрескивания и отслоения под действием приложенных или реактивных напряжений. Последняя из перечисленных причин особенна важна, так как большинство суперсплавов работает в условиях циклического изменения температуры, что сопровождается возникновением напряжения из-за разницы в термическом расширении между оксидным слоем и сплавом. Результаты термоциклирования проиллюстрированы рис. 11.4, где сопоставлены изменения массы сплава при изотермической выдержке и при термоциклировании. Скорость прироста массы сначала примерно одинакова при обоих режимах. Однако в конце концов у материала, подвергающегося термоцик-лировавию, она достигает максимума и далее снижается. Этим снижением она обязана явлению откалывания оксидного слоя, которое фактически возникает из-за более интенсивного сгорания сплава. Во многих случаях, подобных представленному на рис. 11.4, интенсивность циклического окисления можно аппроксимировать выражением: Lm/A = fciff/ - kt, (11.8) где fcj - константа скорости роста оксидного слоя, а А: - константа скорости его откалывания [7]. 11.2. Окисление сплавов системы М-Сг (образующих соединение CfjOj) У очень многих никелевых суперсплавов, а в общем-то и многих суперсплавов на основе Со и на основе Ni, стойкость к окислению обеспешвают посредством образования окалины из СГ2О3. Поэтому сейчас мы рассмотрим окисление двойных сплавов с хромом. По особенностям окисления никель-хромовые сплавы можно подразделить на 3 группы [8]. Группа I - разбавленные сплавы (<10 % Сг). Картина их окисления подобна представленной на рис. 11.3,а - наружная окалина образована соединением NiO, а внутреннее окисление приводит к образованию выделений CfjO,. В этой 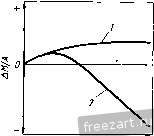 Рис.11.4. Гравиметрическая диаграмма окисления одного и того же сплава при постоянном (i) и циклическон нагреве (2) (схема) (А - площадь поверхности образца) группе константы скорости несколько больше, чем у чистого Ni, потому что окалина NiO содержит малые количества Сг, а это повышает коэффициент диффузии никеля. В группе III (*30% Сг) картина окисления подобна представленной на рис. 11.3,5, т.е. образуется наружная окалина из CrjO,. В этой группе константы скорости на несколько порядков величины меньше, чем у чистого Ni. В группе II наружную окалину СГ2О3 наблюдают по границам зерен, в то время как наружная окалина NiO образуется по телу зерен с одновременным выделением внутренних оксидов CrjO,. Для образования окалин, состоящих только из соединения СГ2О3, содержание хрома в сплаве должно быть 30 % (по массе). Качественно окисление сплавов Со-Сг и Fe-Сг аналогично окислению сплавов Ni-Cr. Однако константы скоростей роста СгОз на никелевых, кобальтовых и железных сплавах меняются на два порядка величины, не проявляя при этом какой-либо корреляции с особенностями состава и структуры сила- ва-подложки. Рост Сг2О3 Видимая изменчивость постоянной роста СгО^ заставляет рассмотреть структуру дефектов и механизм роста СГ2О3. В обзоре литературы по стехиометрии [Ю] сделан вывод, что в этом соединении преобладающим видом ионных дефектов при низком значении /jOj являются внедренные ионы Сг, компенсированные электронами, а при высоких рО СгО^ представляет собой природный полупроводник. Измерение коэффициента Зеебека (Seebeck) также указывает на преобладание Имеется в виду определение термопарного эффекта термоэлектродвижущей силы Прим. перев. внедренных ионов хрома при низком рО [И]. Обратимся, однако, к данным о зависимости от р02, проявляемой коэффициентом диффузии у монокристаллического СГ2О3 [12] и отклонением от стехиомЬтрии у поликристаллического СГ2О3 [13]; эти данные свидетельствуют, что преобладающим видом дефектов являются вакансии ионов Сг. Не следует, правда, считать подобные измерения заведомо отрицающими справедливость данных о преобладании дефектов типа внедренных ионов Сг, ибо наиболее высокое из значений рО, соответствовавших преобладанию последних в опытах по термопарному эффекту, было примерно на четыре порядка величины меньше, чем самое низкое из значений рО, использованных при измерении коэффициента диффузии. Возможно, следовательно, что в соединении СГ2О3 вакансии хрома являются преобладающим видом ионных дефектов при более высоких, а внедрен- ные ионы хрома - при более низких значениях /jOj, тогда как полупроводниковая природа поведения СГ2О3 соответствует некоторому промежуточному, переходному режиму. В большинстве случаев все, что было только что сказано о дефектах кристаллической решетки СГ2О3, неприменимо к росту этого соединения на поверхности чистого хрома или содержащих его сплавов, поскольку, как стало ясно, в явлении роста доминируют процессы диффузии по кратчайшему пути. Константа скорости роста СГ2О3, вычисленная с использованием уравнения (11.5) и коэффициента решеточной диффузии Сг в СГ2О3, всегда на много порядков величины меньше, чем соответствующее экспериментальное значение для скорости роста поликристаллического СГ2О3 [12, 14]. Так же и в редких случаях, когда формируется монокристаллическая окалина СГ2О3, скорость роста на порядки величины ниже, чем у поликристаллической окалины [15]. Монокристаллические окалины получаются ровными и плоскими, тогда как поликристаллические вспучиваются и отслаиваются от подложки. Наблюдения подобного рода привели к предположению, что в оксиде границы зерен и представляют собой кратчайший путь для диффузии катионов и, может быть, анионов [16]. В самом деле, есть данные [16], что скорости роста CtjOg зависят от размера зерен. Представляется вероятным, следовательно, что в очень большой степени изменчивость скоростей роста окалины СГ2О3 связана с особенностями ее микроструктуры и возможностью диффузии по кратчайшему пути. Однако количественное выражение этой связи пока не найдено. Роль активно окисляющихся элементов и дисперсных оксидных выделений Согласно ряду исследований [17-20] малые добавки редкоземельных и других активно окисляюш,ихся элементов изменяют стойкость к окислению у сплавов, образующих соединение CrOj. Обычно благодаря этим добавкам достигают сплошности окалины из СгОз при меньших содержаниях хрома в сплаве (1), скорость роста СгОз становится ниже (2), улучшается адгезия окалины (З), меняется основной механизм роста оксида - вместо миграции катионов изнутри к поверхности происходит миграция анионов вовнутрь материала (4), размер зерен окалины СгОз уменьшается (5). Аналогичные явления наблюдали и в тех случаях, когда до начала окисления активно окисляющиеся добавки присутствовали в сплаве в виде мелкодисперсных оксидных выделений [21-25]. Рис. 11.5 иллюстрирует снижение скорости роста окалины и усиление адгезии CrOj под влиянием добавок Се. Указанные явления объясняли по-разному: 1) дисперсоид накапливается на поверхности раздела металл-оксид и, в конечном счёте, сдерживает диффузионный перенос [211; 2) частицы дисперсоида служат местом гетерогенного зарождения зерен оксида, способствуя укорочению расстояния между зарождающимися зернами и ускорению образования сплошной пленки СГ2О3, которая, следовательно, отличается более мелким зерном 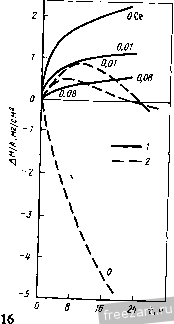 Рис.11.5. Сплав Ni -50% (ат.) Сг Влияние добавок Се (числа у кривых) на окисление при постоянном (-) и цикличес-\ Z агреве до 1100 ос в атмосфере [20] и пониженным количеством кратчайших путей для диффузии катионов (возможно, дислокаций); в результате скорость роста окалины контролируется диффузией анионов [24], или 3) оксидные частицы активно окисляющихся элементов, будучи зародышами для зерен окалины, измельчают ее микроструктуру, а их ионы препятствуют зернограничному переносу материала, необходимого для роста СгОз [20]. К аналогичньш последствиям приводило нанесение порошка CeOj на поверхность никель-хромового сплава, а ионная имплантация таких элементов, как Y и Се, подавляла рост СгОз на сплавах Ni-Cr [26] и Fe-Ni-Cr [27]. Роль летучести оксидов Сплавы, на которых образуется защитная окалина СгОз, склонны к ускоренной утрате этой защиты при очень высоких температурах в газовой среде с высоким значением /гО, поскольку в этих условиях идет реакция: СгРз(тв.) + \ 02(газ.) = Сг20з(газ.). (11.9) Испарение СГ2О3 приводит к непрерывному утонению окалины, поэтому скорость диффузионного переноса сквозь окалину велика. Влияние летучести на кинетику окисления хрома исследовано специально [28]. Результаты исследования представлены на рис. 11.6. В начале процесса диффузия сквозь окалину происходит быстро, так что влияние летучести СгОз не столь заметно. С утолщением окалины скорость испарения CrOj становится сравнимой, а затем уравнивается со скоростью диффузионного роста окалины. Эти 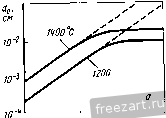 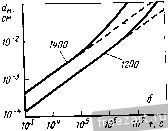 10 70* 10 10 ЮЧ.С Рис.11.6. Зависимость окисления Сг от испарения СЮу а - толщина оксидного слоя со временем достигает насыщения; - скорость уменьшения толщины металла увеличивается со временем 128J условия почти линейного окисления приводят к установлению некоторой предельной толщины окалины Xq, при которой dx/ dt = 0 (показано схематически на рис. 11.6,а). Установление предельной толщины окалины свидетельствует о реализации ее защитных свойств, но при этом расходуемое количество металла увеличивается, пока скорость расхода не достигнет некоторой постоянной величины (для больщей ясности см. рис. 11.6,5). При очень высоких температурах эта проблема ставит одно из главных ограничений использованию сплавов и покрытий, формирующих окалину CrOj. Трудности становятся значительными около 1000 °С, а в быстром газовом потоке-и при более низких температурах. В этих условиях более стойки сплавы, формирующие окалину AljOj, поскольку в системе А1-О нет веществ с достаточно высокой упругостью паров. 11.3. Системы, формирующие соединение AljOj. Сплавы-покрытия Помимо хрома, критическую роль в окислении суперсплавов, упрочняемых выделениями у'-фазы, играет алюминий. На этом основано применение диффузионного защитного алюминидного покрытия NiAl и покрытий типа MCrAlY оверлей (overlay). Последние специально рассмотрены в гл. 13, так что здесь мы будем иметь дело с явлениями формирования и адгезии только AljOj. Роль концентрации алюминия Исходя из одних только термодинамических предпосылок образования окалины, состоящей исключительно из AlOj, следует ожидать при весьма низких содержаниях Al, например 10 % (ат.) [29]. В действительности кинетика процесса лимитирована существованием противодействующих диффузионных потоков в сплаве, а именно, кислорода вовнутрь и алюминия изнутри. Эти потоки приводят соответственно к неза-щитиому внутреннему либо защитному поверхностному окислению. Аналогично окислению в системе Ni-Сг окалина из чистого AljOj может формироваться (вместо внутреннего окисления, приводящего к образованию дискретных выделений AljOj), если А1 хватает для образования оксидных частиц в таком количестве (критической молярной доле), чтобы эти 18 частицы соприкасались друг с другом. Рост аружнои окли ны из АЬОз поддерживается в том случае, если поток А1 в сплаве пеУкрывает количество Al, расходуемого на рост окалины: А1 с плав А1 оксид- (11.10) го 30 -г 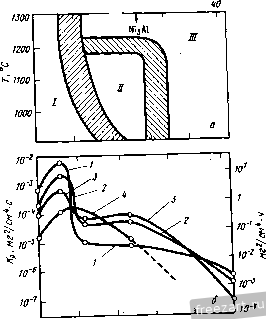 S 10 15 го 25 по массе) Рис.11.7. Зависимость окисления дво<1гных сплавов Ni-А1 от химического состава: а - карста температурной зависимости состава оксидной фазы (область I: 0-6 % (по массе) AI, образуются виутреииие оксиды А120з(+№А1204) и поверхностная окалина NiO; область П; 6-17% (по массе) А1, вначале образуется поверхностный слой AI2O3, но его дальнейший рост нечем поддержать из-за иедоста-точиой подачи AI, поэтому идет преимуществеиио быстрый рост смешанного оксидного слоя NiO+NiAljO+AIjO,; область Ш: >17 % (по массе) AI, происходит рост поверхисвтчрго слоя AI2O3, обеспеченный достаточной подачей А1; б- скорость ( параболическая ) роста окалины кр, соответствуюшая условиям и режимам, рассмотренным применительно к (а) 129] (2 - 1200 оС; 2 - 1100 °С; 3 - 1000 °С; 4 - 900 °С; с ростом температуры картина окисления смешается в направлении области Ш, которая таким образом реализуется при более низком содержаний АО Окисление системы Ni-Al характеризуется тремя зонами, изображенными на рис. 11.7,а. Зоне/ соответствует содержание Al от О до 6%; здесь образуются внутренние оксидные выделения AljOj (+NiAl204) и наружная окалина NiO. В зоне при содержании Al в количестве 6-17% сначала образуется поверхностный слой AljOj, но для поддержания его роста не хватает Al и происходит быстрое образование смеси NiO + NiAljO + AI2O3. В зоне / 17 % Al) рост наружной окалины из AljOj поддерживается достаточным притоком А1. Повышение температуры расширяет эту зону в сторону более низких концентраций Al. Смена в условиях образования окалин сопровождается немедленной сменой кинетики окисления (рис. 11.7,6). При низких содержаниях Al параболическая скорость роста A:p(NiO) повышена примерно на порядок величины из-за того, что в окалине NiO присутствуют ионы АР и происходит некоторое количество внутреннего окисления. Когда образуется больше AI2O3 (зона ), величина кр становится меньше на 1-2 порядка величины. С ростом температуры понижается скорость роста окалины, так как увеличивается склонность к образованию только соединений AljOj. При содержании А1 25% образуется только AI2O3, и величина кр снижается еще на 1-3 порядка величины. Влияние добавок хрома Сплавы на основе Ni(Co,Fe), содержащие обе противоокисли-тельные добавки Сг и Al, выигрывают из-за существенного синергического влияния этих элементов, приносящего громадные технологические выгоды. Так, добавки Сг около 10% (по массе) могут вызвать образование окалины AI2O3 на сплавах', содержащих всего лишь 5% (по массе) А1 (в отличие от 17% Al у двойных сплавов!). Эта особенность позволила разработать более пластичные и устойчивые диффузионные покрытия MCrAl, а также составы матриц для сплавов, упрочняемых дисперсными оксидными выделениями. Управляющую роль химического состава по отношению к окислению легче всего обобщить с помощью карт, на которых представлены оксиды, образуемые компонентами окалины, а также изменения массы в функции содержания Сг и Al. На рис. 11.8,а изображены три главных характеристических зоны окисления: зона /, соответствующая образованию поверх-20 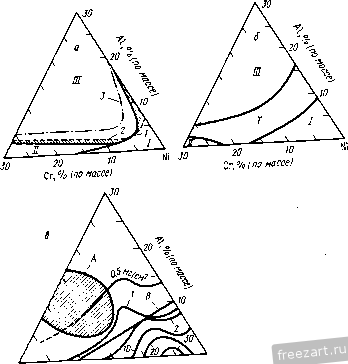 20 10 Zrf/o (по пассе] Рис.11.8. Зависимость окисления тройных сплавов Ni-Сг-А1 от химического состава [30-33]. а - карта изотермического нагрева при 1000 и 1100 К., 20 ч (2), при 1200 С, 20 ч (2), 1000 °С (3); область / - поверхностный слой NiO и внутренние оксиды Сг20з/А120з/№(А1,Сг)204; область - поверхностный слой CrjO, и внутренние оксиды AljO,; область / - поверхностный слой AI2O3; б - карта циклического нагрева при 1100 4:, 500 ч, и 1200 <Ч:, 200 ч; область / - в основном NiO; область II - % основном СГ2О3; область / - AljOjC+NrAUO область / - переход от NiO к №Сг204, №А1204*и AljOj; в -контурная (-) карта изменений массы образца на единицу его поверхности (AW 4, мг/см*) за 8 ч изотермического нагрева при 649 С; область А - составы сплавов-покрытий; область В - составы суперсплавов костных окалин NiO и внутренних подокалинных окислов А12О3/СГ2О3; зона , отвечающая образованию поверхностной окалины СГ2О3 и подокалинных слоев AI2O3, и зона /, в которой формируется только поверхностная окалина AlJO-Продолжительные окислительные циклы вызывают существенное сужение зоны оптимальной противоокислительной стойкости в направлении повышенного содержания А1 и Сг (рис. 11.8,5). На освободившемся месте формируется обширная переходная зона, характеризующаяся отслоением окалины, ускорением расхода алюминия и образованием сложных окалин NiO + Роль Сг в образовании окалины AlOj при значительно меньшем содержании AI, чем в бинарной системе, можно охарактеризовать в терминах хорошо известного геттерного эффекта [34]. Это явление [30, 35] лучше всего можно иллюстрировать деталями механизма промежуточного окисления в системе Ni-15Cr-6Al, схематически представленными на рис. 11.9 [35]. а. Исходный оксид включает все катионы, присутствующие непосредственно в поверхностном слое сплава, так что этот слой превращается в систему 15 % NiO - 85 % Ni (Сг,А1)20ц 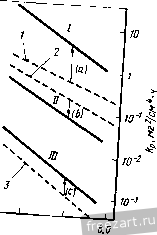 СппаВ СппаВ  ооооооооооооо Al f СппаВ J 7,0 7,5 t/T. 10-*/(-  г СппаВ Рис.гг.9. Сияергическое влияние Сг иа создание окалин AljOjj геттерное действие при переходном процессе окисления сплава (см. текст) Ni-15Cr-6Al ед течение 1 мин (а), 5 мин {б\ 40 мин (в) и более 40 мин (г) РнсП.Ю. Сравнение параболических констант скорости окисления кр (даны кривые Аррениуса) у различных сплавов системы №-Сг-А1 (-) групп /, II и lXWO]-- соответственно у Ni (i). сплава Ni-ЗОСг (2) и сплава (быстрый перенос катионов вызывает также некоторый переизбыток NiO). б. Происходит подокалинное образование Crfi поскольку это соединение устойчиво при низкой активности кислорода, продиктованной равновесием в системе NiO-сплав; впереди этого фронта идет внутреннее окисление и образуются выделения AlGj, поскольку они устойчивы при еще меньшей активности кислорода. в. Высокое содержание хрома обеспечивает формирование сплошного подокалинного слоя СгОз- Это приводит к установлению более низкой активности кислорода в системе окалина-сплав, сдерживает диффузию кислорода и образование AljOj по реакциям внутреннего окисления. Рост NiO/Ni(Cr,Al)204 также останавливается. В конечном -счете подокалинный слой AljOj становится сплошным и начинает контролировать процесс окисления. При 1000 °С состояние насыщения обычно наступает меньше, чем через час. Можно видеть, что подобное кооперативное действие хрома имеет очень серьезную основу,-благодаря участию хрома, зарождению а(А120з) на поверхности раздела оксид-металл [38] предшествует образование знакомых нам смесей кристаллографически когерентных субзерен окалины, легированных Ni(Cr,Al)P4 и (Сг,А1)Рз. Скорости роста оксидного слоя можно подразделить на три диапазона, отличающихся друг от друга более, чем на порядок величины [30, 36, 37, 39] (рис. 11.10), т.е. кр{\) > kpill) > kp{\ll). Рисунок дает интересную возможность сравнить характер окисления чистого Ni и сплавов группы I, сплава Ni-30Cr и сплавов группы П, сплава Ni-25A1 и сплавов группы П1. В этих трех случаях разница, возникающая под влиянием третьего компонента, является, соответственно, следствием образования NiO, легированного алюминием и хромом (1), геттерной роли алюминия как фактора, регулирующего образование СгОз (2), повышенного содержания хрома в А10 (3). Контурная карта рис. 11.8,в позволяет несколько подробнее проанализировать изменение массы. Она показывает, что максимального сопротивления окислению можно ожидать для систем, содержащих >10% Сг и >10% Al, т.е. в той области составов, к которой относятся реальные покрытия системы Ni-Cr-Al. Есть указания, что добавки Сг менее 10% вредны для систем Ni-Al, особенно в условиях длительных выдержек (100-500 ч) или при циклических режимах [32, 33]. Но это противоречит некоторым исследованиям [30, 40] и не может быть предсказано на основании одних только карт оксидных фаз (рис. 11.8,а и 11.8,5). Однако на стойкость к окислению добавки А1 в количестве более 3-5% всегда оказывают благотворное влияние (см. рис. 11.7) [29, 32, 33, 39, 40]. Влияние добавок элементов, активно реагирующих с кислородом. Механизм роста окалины Alfi и ее сцепления с подложкой Редкоземельные элементы (активно взаимодействующие с кислородом) вызывают столь же масштабные изменения в характере окисления сплавов системы MCrAl, как и добавки хрома и алюминия. Малые (<1%) количества редкоземельных элементов предотвращают отслаивание окалины AljOj, которое при их отсутствии неизбежно происходит по поверхности раздела оксид-металл. Обычно прочность связи окалины и подложки анализируют в связи с явлениями диффузии, ростом и морфологическими особенностями окалины; мы поступим таким же образом. Диффузия в AljO. Диффузия кислорода в соединении aAljOj происходит преимущественно по границам зерен [41-43]. При типичном размере зерен 1 мкм вклад зернограничной диффузии примерно на четыре порядка величины превосходит вклад решеточной диффузии. Данные, полученные с помощью модели роста окалины AlOj в системе FeCrAl-YOj, также позволяют ожидать преобладания зернограничной диф- . фузии над решеточной [44]. Перенос алюминия сквозь решетку идет значительно быстрее, чем перенос кислорода [45]. О прямом измерении зернограничной диффузии алюминия ничего не известно, но можно полагать, что при типичном размере зерна AlOj в 1мкм вклад решеточной диффузии алюминия близок к вкладу зернограничной диффузии кислорода и увеличивается с ростом размера зерен (или уменьшается с уменьшением размера зерен). Это предположение выглядит особенно справедливым при рассмотрении коэффициентов зернограничной диффузии кислорода, вычисленных с помошью моделей фактического роста окалины AljOj [44]. Изменение размера зерен в зави-24 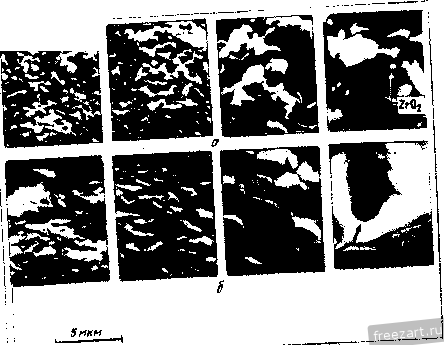 Рис.11.11. Формирование зерен AIOj в результате окисления сплава системы Fe-Cr-AI с добавкой Zr при 100-ч выдержке при высоких температурах: а - поверхность контакта оксид-газ и вид выделений ZrOjj б - поверхность раздела металл-бксид и вид ямок в центральной части крупных зерен AlOj симости ОТ времени, температуры или положения в объеме окалины (рис. 11.11) следует принимать во внимание при обращении к любой модели ее диффузионного роста [41]. Однозначно ответить на вопрос о том, как растет окалина AI2O3, путем диффузии кислорода вовнутрь или путем диффузии алюминия к поверхности, можно только проведя эксперименты по окислению с применением меченых атомов [46]. Немногочисленные опубликованные исследования свидетельствуют, что при высоких температурах (1100 °С) в системе NiCrAl+Y (или Zr) зернограничная диффузия кислорода действительно преобладает [47]. Однако некоторые признаки роста за счет диффузии алюминия к поверхности тоже наблюдали; , этот вариант роста становится существенным при низком содержании легирующей добавки или низких температурах (900 °С), т.е. в условиях, для которых характерны мета- стабильные переходные оксиды алюминия и перенос устойчивых катионов [38, 48-50]. Диффузия алюминия оказывается существенной при 1100 °С у pNiAl без легирующих добавок [46]. У гораздо более крупных катионов, используемых в качестве легирующих добавок, объемная растворимость в окалине AlOj гораздо ниже. По этой причине происходит сегрегация к границам зерен окалины и выделение там оксидов Y, Zr и Th (рис. 11.11) [44, 51]. Точные измерения зернограничной диффузии кислорода или алюминия не известны, вероятно, ее масштабы значительны. Влияние легирующих добавок на кинетику роста окалины, ее морфологию и прочность сцепления с подложкой. Окисление сплавов без легирующих добавок приводит к образованию пленок AI2O3, которые очень слабо сцеплены с подложкой и отслаиваются от нее точно по поверхности раздела оксид-металл. Добавки 0,01-0,1% (по массе) элементов, активно реагирующих с кислородом или редкоземельных, включая (но не только) Sc, У, Zr, La, Hf, Се, Yb и Th, приводят к образованию окалин, которые связаны с подложкой весьма прочно. В обобщенном виде зависимость изотермического и термоцикпического окисления в системах CoCrAl + Y,Hf и NiCrAl + Zr от количества легирующей добавки представлена схематически на рис. 11.12. Область I. Показано, что малые' добавки до некоторой степени замедляют рост окалины (рис. 11.12) и снижают сжимающие напряжения, возникающие в окалины в результате ее роста [52-55]. Снижение веса окалины связывают с Рис.11.12. Схематическая диаграмма. Сравнение влияния добавок (Zr, Y), обладающих высоким сродством к кислороду, на характер окисления (изменение удельной tiw/A, и полной Lw/A) при изотермическом (7) и циклическом (2) нагреве (649 С в течение 100 ч) у сплавов NiCrAI+Zr и CoCrAI+Y [52-54]. Области: / - плохая адгезия, медленный рост окалины; II - хорошая адгезия, медленный рост окалииы; III - хорошая адгезия, ускоренный рост окалины 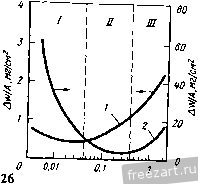 уменьшением ее вспучивания (под действием сжимающих напряжений) и снижением ее общей поверхности при росте тол-шины (рис. 11.13, а, б). Нередко подобные наблюдения объясняют особенностями напряжений роста , вносимыми образованием оксидных выделений в окалины по границам ее зерен [56-58]. Этот вывод подтверждают опыты с мечеными атомами кислорода С*0); показано, что они скапливаются в объеме уже образованной окалины у нелегированных сплавов NiAl [46]. Поэтому складывается мнение, что внутри окалины могут образовываться новые оксиды, а диффузия алюминия к поверхности сплава ответственна за возникновение напряжений роста и вспучивание. При весьма малых содержаниях добавки пористость на поверхности раздела может быть сильно понижена (рис. 11.13, б) (52, 56, 59]. Наконец, прочность сцепления окалины с подложкой резко возрастает с повышением содержания добавки, об этом свидетельствует 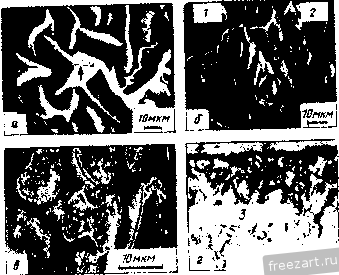 Рис.11.13. Изменения в морфологии окалины у сплавов системы Ni-Сг-А1 при введении различных добавок Zr (а, б, в - выдержка 8 ч при 1100 °С, г - выдержка 200 ч при 1200 °С): а - 0% Zr, вспученная окалина с трещинами (показано стрелкой); б - 0,04% Zr, частичное отставание окалины и образование на ней борозд, поры отсутствуют; в - 0,12 % Zr, отставания или вспучивания окалины нет; г - 1,10 % Zr, активное формирование подокалинного слоя; / - неповрежденный оксидный слой; 2 - обнаженный металл; 3 - трещины в наружной окалине 1 2 3 4 ... 19 |
||||||||||||||||||||||||||||||
 |
 |